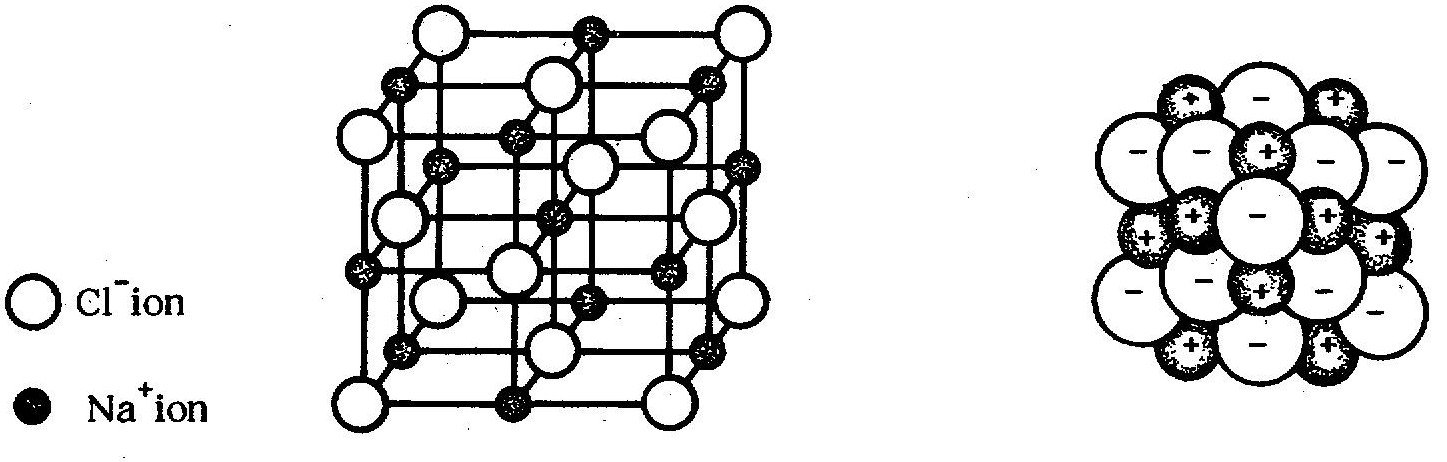
ตัวอย่างเช่นโครงสร้างของผลึกโซเดียมคลอไรด์เป็นของแข็ง รูปลูกบาศก์ ใสไม่มีสีในผลึก มีโซเดียมไอออนสลับกับคลอไรด์ไอออน เป็นแถว ๆ ทั้งสามมิติ มีลักษณะคล้ายตาข่าย โดยที่แตละไอออนจะมีไอออนต่างชนิดล้อมรอบอยู่ 6 ไอออน ดังรูป 2 รูป ข้างล่างดังนี้
เนื่องจากโลหะมีค่าพลังงานไอออไนเซชันต่ำ และอโลหะมีค่าพลังงานไอออไนเซชันสูง ดังนั้นพันธะไอออนิกจึงเกิดระหว่างธาตุโลหะ และอโลหะได้ดี กล่าวคือ อะตอมของโลหะให้เวเลนต์อิเล็กตรอนกับอะตอมของอโลหะ แล้วเกิดไอออนบวกของโลหะ และไอออนลบของอโลหะ ไอออนทั้งสองจะส่งแรงดึงดูดระหว่างประจุบวกและลบ เกิดเป็นพันธะไอออนิก
และการที่โลหะให้เวเลนต์อิเล็กตรอนแก่อโลหะ เพื่อปรับให้มีเวเลนต์อิเล็กตรอนเป็นแปด แบบก๊าซเฉื่อย ส่วนอโลหะรับเวเลนต์อิเล็กตรอนมานั้นก็เพื่อปรับตัวเองให้เสถียรแบบก๊าซเฉื่อยเช่นกัน ไอออนบวกกับไอออนลบจึงดึงดูดกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเกิดเป็นสารประกอบไอออนิก (Ionic compound) ดังนี้
การเกิดสารประกอบโซเดียมคลอไรด์ (NaCl) จากโซเดียม (Na) และ คลอรีน (Cl)
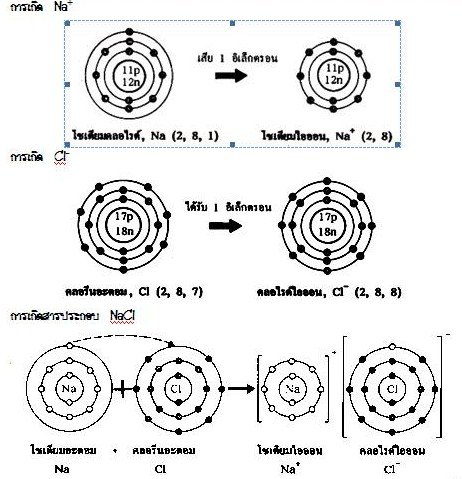
3.2.1 การเกิดพันธะไอออนิก
การเกิดพันธะไอออนิก เกิดระหว่างโลหะกับอโลหะ ยกเว้น Be กับ B โดยโลหะจ่ายอิเล็กตรอนออกไปกลายเป็นประจุบวก อโลหะรับอิเล็กตรอนเข้ามากลายเป็นประจุลบ ประจุบวกและประจุลบที่เกิดขึ้นจะส่งแรงดึงดูดกัน เรียกว่า พันธะไอออนิก3.2.2 สูตรเคมีและชื่อของสารประกอบไออนิก
การเขียนสูตรสารประกอบไอออนิกการเขียนสูตรของสารประกอบไอออนิกใช้หลักดังนี้
1. เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบของอโลหะ หรือกลุ่มไอออนลบ ยกเว้นสารประกอบไอออนิกที่เป็นเกลืออะซิเตต (CH3COO-) จะเขียนกลุ่มไอออนลบไว้ก่อนแล้วตามด้วยไอออนบวกของโลหะ เช่น CH3COONa , (CH3COO)2Ca
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหาตัวเลขมาคูณกับจำนวนประจุบนไอออนบวก และไอออนลบให้มีจำนวนประจุเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้มุมขวาล่างของแต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือกลุ่มไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวา
ตารางที่1 ไอออนบวกบางชนิดที่ควรทราบ
| ไอออน+1 | ไอออน+2 | ไอออน+3 | ไอออน+4 | ||||
| ลิเทียม โซเดียม โพแทสเซียม ซิลเวอร์ ไฮโดรเจน คอปเปอร์ แอมโมเนีย เมอร์คิวรี (I) |
Li+ Na+ K+ Ag+ H+ Cu+ NH3+ Hg+/Hg22+ |
แมกนีเซียม แคลเซียม แบเรียม สตรอนเทียม ซิงค์ เลด (II) คอปเปอร์(II) โคบอลต์ (II) ไอร์ออน(II) ทิน (II) แมงกานีส(II) เมอคิวรี (II) |
Mg2+ Ca2+ Ba2+ Sr2+ Zn2+ Pb2+ Cu2+ Co2+ Fe2+ Sn2+ Mn2+ Hg2+ |
อลูมิเนียม โครเมียม(III) ไอร์ออน(III) |
Al3+ Cr3+ Fe3+ |
เลด (IV) ทิน (IV) แมงกานีส(IV) |
Pb4+ Sn4+ Mn4+ |
ตารางที่2 ไอออนลบบางชนิดที่ควรทราบ
| ไอออนลบ1 | ไอออนลบ2 | ไอออนลบ3 | |||
| ฟลูออไรด์ คลอไรด์ โบร์ไมด์ ไอโอไดด์ ไฮดรอกไซด์ ไนเตรต ไนไตรต์ ไฮโดรเจนคาร์บอเนต ไฮโดรเจนซัลเฟต ไฮโดรเจนซัลไฟต์ คลอเรต คลอรัส เปอร์คลอเรต ไฮโปคลอไรด์ เปอร์แมงกาเนต ไซยาไนต์ ไฮโดรเจนซัลไฟต์ ไดไฮโดรเจนซัลไฟต์ |
F- Cl- Br- I- OH- NO3- NO2- HCO3- HSO4- HSO3- ClO3- ClO2- ClO4- ClO- MnO4- CN- HS- H2PO4- |
ออกไซด์ ซัลไฟด์ ซัลเฟต ซัลไฟต์ ไธโอซัลเฟต คาร์บอเนต โครเมต ไดโครเมต แมงกาเนต ไฮโดรเจนฟอสเฟต |
O2- S2- SO42- SO32- S2O32- CO32- CrO42- Cr2O72- MnO42- HPO42- |
ไนไตรด์ ฟอสไฟต์ ฟอสเฟต |
N3- P3- PO43- |
การเรียกชื่อสารประกอบไอออนิก
การเรียกชื่อสารประกอบไอออนิกมีหลักเกณฑ์ดังนี้
1. สารประกอบธาตุคู่(Binary compound) ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมตัวกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก แล้วตามด้วยชื่ออโลหะที่เป็นไอออนลบโดยลงเสียงพยางค์ท้ายด้วย ไอด์ (ide) เช่น
ออกซิเจน เปลี่ยนเป็น ออกไซด์ (oxide)
ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride)
คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride)
ตัวอย่าง การอ่านชื่อสารประกอบไอออนิกธาตุคู่
NaCl อ่านว่า โซเดียมคลอไรด์
CaI2อ่านว่า แคลเซียมไอโอไดด์
KBr อ่านว่า โพแทสเซียมโบรไมด์
NH4Cl อ่านว่า แอมโมเนียมคลอไรด์
ถ้าสารประกอบที่เกิดจากธาตุโลหะเดียวกันที่มีไอออนได้หลายชนิด รวมตัวกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวกแล้วตามด้วยค่าประจุของไอออนโลหะโดยวงเล็บเป็นเลขโรมัน แล้วตามด้วยอโลหะที่เป็นไอออนลบโดยเปลี่ยนเสียงพยางค์ท้ายเป็นไอด์ (ide) เช่น
Fe เกิดไอออนได้ 2 ชนิด คือ Fe2+และ Fe3+
FeCl2อ่านว่า ไอร์ออน (II) คลอไรด์
FeCl3อ่านว่า ไอร์ออน (III) คลอไรด์
Cu เกิดไอออนได้ 2 ชนิด คือ Cu+และ Cu2+
Cu2S อ่านว่า คอปเปอร์ (I) ซัลไฟด์
CuS อ่านว่า คอปเปอร์ (II) ซัลไฟด์
2. สารประกอบธาตุสามหรือมากกว่าถ้าสารประกอบเกิดจากไอออนบวกของโลหะ หรือกลุ่มไอออนบวกรวมตัวกับ กลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะ (โลหะนั้นเกิดไอออนบวกได้ชนิดเดียว) หรือกลุ่มไอออนบวก แล้วตามด้วยชื่อกลุ่มไอออนลบ เช่น
Na2SO4 อ่านว่า โซเดียมซัลเฟต
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
KNO3 อ่านว่า โพแทสเซียมไนเตรต
Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์
(NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต
ถ้าสารประกอบเกิดจากโลหะที่เกิดไอออนได้หลายชนิดรวมตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะแล้ววงเล็บค่าประจุของไอออนบวกนั้น แล้วจึงอ่านชื่อกลุ่มไอออนลบตามหลัง เช่น
Cr เกิดไอออนได้ 2 ชนิด คือ Cr2+กับ Cr3+
CrSO4 อ่านว่า โครเมียม (II) ซัลเฟต
Cr2(SO4)3 อ่านว่า โครเมียม (III) ซัลเฟต
Hg เกิดไอออนได้ 2 ชนิดคือ Hg22+(Hg+) และ Hg2+
Hg2(NO3)2 อ่านว่า เมอคิวรี (I) ไนเตรต Hg(NO3)2อ่านว่า เมอคิวรี (II) ไนเตรต
3.2.3 พลังงานกับการเกิดสารประกอบไออนิก
ในการเกิดสารประกอบไอออนิก จะมีการเปลี่ยนแปลงหลายขั้นตอนย่อย ๆ และแต่ละขั้นตอนย่อยจะมีการเปลี่ยนแปลงพลังงาน เช่นการเกิดโซเดียมคลอไรด์จากโลหะ Na กับก๊าซ Cl2
Na (s) +1/2 Cl2(g)------> NaCl (s)
การเกิด NaCl มีขั้นตอนต่าง ๆ และพลังงานเกี่ยวข้องดังนี้
ขั้นที่ 1 (DH1= พลังงานการระเหิด)
Na (s) -----------> Na (g) DH1= +109 kJ/mol
ขั้นที่ 2 (DH2= พลังงานสลายพันธะ)
1/2 Cl2(g) -------------> Cl (g) DH2= +121 kJ/mol
ขั้นที่ 3 (DH3= พลังงานไอออไนเซชัน)
Na (g) ---------------> Na+(g) + e-DH3= +494 kJ/mol
ขั้นที่ 4 (DH4= พลังงานสัมพรรคภาพอิเล็กตรอน)
Cl2(g) + e---------------> Cl-(g) DH4= -347 kJ/mol
ขั้นที่ 5 (DH5= พลังงานแลตทิช)
Na+(g) + Cl-(g)------------> NaCl (s) DH5= -787 kJ/mol
เมื่อรวมขั้นที่ 1 ถึง 5 เข้าด้วยกันจะได้
Na (s) + 1/2 Cl2(g)-----------------> NaCl (s) DH = -410 kJ/mol
แสดงว่าการเกิด NaCl เป็นการเปลี่ยนแปลงแบบคายพลังงานเขียนแผนภาพ แสดงขั้นตอนการเปลี่ยนแปลงพลังงานต่าง ๆ ในการเกิดสารประกอบไอออนิกได้ดังนี้
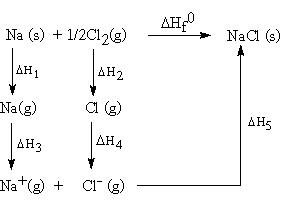
เรียกแผนภาพดังกล่าวว่าBonr - Haber cycle
ในการเกิดสารประกอบไอออนิกจากโลหะและอโลหะนั้น จะมีพลังงานเกี่ยวข้อง 2 แบบ คือ ขั้นที่ 1 , 2 , 3 เป็นแบบดูดพลังงาน ส่วนขั้นตอนที่ 4 และ 5 เป็นแบบคายพลังงาน ดังนั้น
พลังงานในการเกิด NaCl (DH) = DH1+ DH2+ DH3+DH4+ DH5
= (+109) + (+121) + (+494) + (-347) + (-787)
= -410 kJ/mol
การเกิดสารประกอบไอออนิกจากโลหะกับอโลหะนั้นโดยทั่วไปมีพลังงานเปลี่ยนแปลง 2 แบบคือการเกิดสารประกอบไอออนิกแบบคายพลังงาน จะมีพลังงานในขั้น 1 , 2 , 3 (DH1, DH2และ DH3) ที่ดูดเข้าไปทั้งหมดน้อยกว่า พลังงานที่คายออกมาจากขั้นที่ 4 และ 5 (DH4และ DH5) และ
* การเกิดสารประกอบไอออนิกแบบดูดพลังงาน จะมีพลังงานในขั้น 1 , 2 , 3 (DH1, DH2และ DH3) ที่ดูดเข้าไปทั้งหมดมากกว่า พลังงานที่คายออกมาจากขั้นที่ 4 และ 5 (DH4และ DH5)
ส่วนมากการเกิดสารประกอบไอออนิกมักจะเป็นแบบคายพลังงาน โดยเฉพาะการเกิดสารประกอบไอออนิกของธาตุหมู่ 7A
3.2.4 สมบัติของสารประกอบไอออนิก
1.มีขั้ว (Polar nature) สารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมากซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า2.นำไฟฟ้าได้ เมื่อใส่สารประกอบไอออนนิกลงในน้ำ ไอออนจะแยกออกจากัน ทำให้สารละลายนำไฟฟ้าได้ ในทำนองเดียวกัน สารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วย เนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกันเกิดการไหลเวียนอิเลคตรอน ทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3.มีจุดหลอมเหลวและจุดเดือดสูง เพราะต้องการพลังงานความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวหรือกลายเป็นไอตามที่ต้องการ
4.การละลาย (Solubility) สารประกอบไอออนิกจะละลายในน้ำแต่ไม่ละลายในเบนซีนหรือตัวทำละลายอินทรีย์ น้ำและตัวทำละลายชนิดมีขั้วอื่น ๆ จะมีค่า dielectric constant สูง ซึ่งจะทำให้แรงดึงดูดไฟฟ้าที่ดึงดูดระหว่างไอออนอ่อนลง ทำให้ไอออนแยกจากกัน การประทะกัน (interaction) ระหว่างไอออนและโมเลกุลที่มีขั้ว (Polar nature) จึงช่วยในขบวนการ dissociation (disssociation เป็นขบวนการที่สารแตกตัวออกเป็นไอออนเมื่อละลายในน้ำ) ตัวทำละลายอินทรีย์ มี dielectric constant ต่ำและมักเป็นสารประกอบที่ไม่มีขั้ว สารประกอบไอออนิกโดยทั่ว ๆ ไปจะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว
5.สารประกอบไอออนิกทำให้เกิดปฏิกริยาไอออนิก คือ ปฏิกริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฎิกริยาจึงเกิดทันที
6. สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
3.2.5 สมการไอออนิกและสมการไอออนิกสุทธิ
เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้สารละลายที่มีไอออนของสารทั้งสองปนกันอยู่ ปรากฏเป็นสารละลายใสเช่น ผสม NaCl (aq) กับ KNO3(aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
NaCl (aq) + KNO3(aq) ---------> NaNO3(aq) + KCl (aq)
หรือ Na+(aq) + Cl-(aq) + K+(aq) +NO3-(aq) ------------> Na+(aq) + NO3-(aq) + K+(aq) + Cl-(aq)
เมื่อผสมกัน จะมีไอออนอยู่ในสารละลายทั้ง 4 ชนิด แสดงว่า ไม่เกิดผลิตภัณฑ์ที่เป็นของแข็ง จึงอยู่ในสภาพไอออน (มีน้ำล้อมรอบ)
แต่เมื่อผสมสารละลายของสารประกอบไอออนิกบางชนิดเข้าด้วยกัน จะได้ผลิตภัณฑ์เป็นตะกอนเกิดขึ้น เช่น
ผสม NaCl (aq) กับ AgNO3(aq) เขียนสมการเคมีที่เกิดขึ้นได้ดังนี้
NaCl (aq) + AgNO3(aq) -----------------> NaNO3(aq) + AgCl (s)
หรือ Na+(aq) + Cl-(aq) + Ag+(aq) +NO3-(aq) ---------------> Na+(aq) + NO3-(aq) + AgCl(s)
เมื่อผสมกันจะเกิดตะกอนของ AgCl(s)
เขียนสมการแสดงการเกิดตะกอน AgCl ดังนี้
Ag+(aq) + Cl-(aq) ---------------> AgCl(s)
เรียกสมการนี้ว่าสมการไอออนิก
สมการไอออนิก(Ionic equation )คือ สมการเคมีที่เขียนเฉพาะไอออนหรือโมเลกุลของสารที่มีส่วนในการเกิดปฏิกิริยา ส่วนไอออนหรือโมลกุลของสารใดไม่มีส่วนในการเกิดปฏิกิริยาไม่ต้องเขียน สมการไอออนิก จะต้องเป็นสมการที่มีสารใดสารหนึ่งเป็นไอออนร่วมอยู่ด้วยในปฏิกิริยานั้น เช่น
Zn (s) + 2H+(aq) ---------------> Zn2+(aq) + H2(g)
H+(aq) + OH-(aq) --------------------> H2O (l)
หลักการเขียนสมการไอออนิก
1. ให้เขียนเฉพาะส่วนไอออนหรือโมเลกุลของสารทำปฏิกิริยากันเท่านั้น
2. ถ้าสารที่เกี่ยวข้องในปฏิกิริยาเป็นสารที่ไม่ละลายน้ำหรือไม่แตกตัวเป็นไอออนหรือเป็นออกไซด์หรือเป็นก๊าซให้เขียนสูตรโมเลกุลของสารนั้นในสมการได้ ตัวอย่าง ออกไซด์ เช่น CO2, H2O ก๊าซ เช่น H2, NH3สารที่ไม่ละลายน้ำ เช่น CaCO3, AgCl
3. ดุลสมการไอออนิกโดยทำจำนวนอะตอมและจำนวนไอออนของธาตุทุกธาตุ ทั้งทางซ้ายและทางขวาของสมการให้เท่ากัน พร้อมทั้งดุลประจุรวมทั้งทางซ้ายและขวาของสมการให้เท่ากัน
ตัวอย่างที่ 1จงเขียนสมการไอออนิก เมื่อนำสารเหล่านี้ละลายน้ำ KOH , BaCl2, H2SO4
วิธีทำ
KOH ละลายน้ำเขียนสมการไอออนิกได้ดังนี้
KOH (s) ------------------> K+(aq) + OH-(aq)
ฺBaCl2ละลายน้ำเขียนสมการไอออนิกได้ดังนี้
BaCl2----------------> Ba2+(aq) + 2Cl-(aq)
H2SO4ละลายน้ำเขียนสมการไอออนิกได้ดังนี้
H2SO4(aq) ---------------------> 2H+(aq) + SO42-(aq)
ตัวอย่างที่ 2จงเขียนสมการไอออนิกที่เกิดจากการผสมสารละลายแต่ละคู่ต่อไปนี้
ก. AgNO3(aq) กับ CaBr2(aq)
ข. CuSO4(aq) กับ K2S (aq)
วิธีทำ
ก.ขั้นที่ 1
AgNO3(aq) + CaBr2(aq) ------------------> 2AgBr (s) + Ca(NO3)2(aq)
ขั้นที่ 2
2Ag+(aq) + NO3-(aq) + Ca2+(aq) + 2Br-(aq) -------------------> 2AgBr (s) + Ca2+(aq) + 2NO3-(aq)
ขั้นที่ 3
2Ag+(aq) + 2Br-(aq) -----------------> 2AgBr (s) สมการไอออนิก
ข.ขั้นที่ 1
CuSO4(aq) + K2S (aq) --------------> CuS (s) + K2SO4(aq)
ขั้นที่ 2
Cu2+(aq) + SO42-(aq) + 2K+(aq)+ S2-(aq) --------------------> CuS (s) + K+(aq) + SO42-(aq)
ขั้นที่ 3
Cu2+(aq) + S2-(aq) -----------------> CuS (s) สมการไอออนิก


ไม่มีความคิดเห็น:
แสดงความคิดเห็น