_ ระดับพลังงานหลัก
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ คือ K, L, M, N, O, P, Q ตามล้าดับ เมื่อ n = 1 จะเป็นระดับพลังงานต่ำสุด หมายความว่า จะต้องใช้พลังงานมากที่สุดที่จะดึงเอาอิเล็กตรอนนั้นออกจากอะตอมได้ จำนวนอิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8 เช่น ____๘ระดับพลังงานที่หนึ่ง n = 1 (shell K) ปริมาณอิเล็กตรอนที่ควรมีอยู่ = 2(1)2 = 2 ____๘ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(2)2 = 8 ____๘ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(3)2 = 18 ____๘ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(4)2 = 32 ____๘ระดับพลังงานที่ห้า (n = 5) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(5)2 = 50 ____๘ระดับพลังงานที่หก (n = 6) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(6)2 = 72 ____๘ระดับพลังงานที่เจ็ด (n = 7) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(7)2 = 98
รูปที่ 1.1 ออร์บิทัล (orbital)
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1249
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1249
เช่น ตารางที่ 1.1 การจัดเรียงอิเล็กตรอนในระดับพลังงานหลักของธาตุต่างๆ

พลังงานย่อยหรือเรียกว่า ซับเซลล์ (sub-levels หรือ sub-shells)
กำาหนดเป็นสัญลักษณ์คือ s p d และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและมีพลังงานไม่เท่ากัน กล่าวคือ ระดับพลังงานย่อย s มีพลังงานต่ำกว่า p ต่ำกว่า d ต่ำกว่า f ตามล้าดับ ในระดับพลังงานย่อยยังประกอบด้วยออร์บิทัล (orbital) ซึ่งในแต่ละออร์บิทัลมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ดังนี้____๘๘๘๘ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1 ออร์บิทัล
____๘๘๘๘ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
____๘๘๘๘ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
____๘๘๘๘ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
__________ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
 รูปที่ 1.2 แสดงระดับพลังงานในอะตอม
รูปที่ 1.2 แสดงระดับพลังงานในอะตอมที่มา : http://www.elecnet.chandra.ac.th/learn/courses/ELTC2103/energyband.html

รูปที่ 1.3 แสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัล
ที่มา : http://www.scimath.org/index.php/socialnetwork/viewbulletin/1189
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลักดังต่อไปนี้
__1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน
__2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
____2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
__________ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง
__________↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
__________↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
____2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน ดังรูปที่ 1.1
__3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
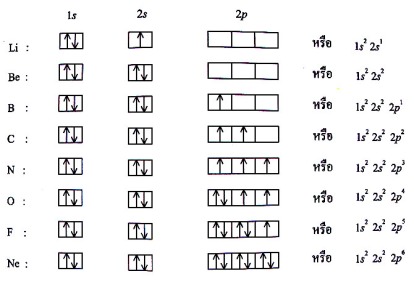
รูปที่ 1.4 โครงแบบอิเล็กตรอน (แบบสัญลักษณ์) ของธาตุ
ที่มา : http://www.vcharkarn.com/lesson/view.php?id=1168
ที่มา : http://www.vcharkarn.com/lesson/view.php?id=1168

รูปที่ 1.5 การบรรจุอิเล็กตรอนในออรืบิทัลแบบเต็ม
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1249
 รูปที่ 1.6 การจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18
รูปที่ 1.6 การจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18ที่มา : http://atomand.blogspot.com/p/1.html

ไม่มีความคิดเห็น:
แสดงความคิดเห็น